Поверхностная активность зависит прежде всего от химической природы и строения самого вещества, от полярности или неполярности его молекул.
Чем же отличаются полярные молекулы от неполярных? Известно, что в молекуле любого вещества имеется одинаковое количество противоположно заряженных частиц — положительно заряженных ядер атомов и отрицательно заряженных электронов, вследствие чего в целом она электронейтральна. Для каждой молекулы можно найти центры их положительных и отрицательных зарядов, подобно тому как в физике находят центры тяжести тел.
Если центры положительных и отрицательных электрических зарядов не совпадают, вокруг молекулы образуется электрическое поле, хотя в целом молекула является нейтральной. Такая молекула носит название полярной или дипольной. Расстояние между центрами положительных и отрицательных электрических зарядов в молекуле называется длиной диполя. Когда же центры противоположных электрических зарядов в молекуле совпадают, длина диполя становится равной нулю. Такая молекула не имеет электрического поля и носит название неполярной.
Неполярными, как правило, являются симметрично построенные молекулы. Примерами таких симметрично построенных, неполярных молекул могут служить предельные углеводороды: молекулы метана — газа или жидких при комнатной температуре углеводородов — пентана, гексана или гептана (составные части бензина и керосина). Они являются гидрофобными и практически нерастворимыми в воде веществами.
Однако если в эти молекулы ввести атомы кислорода, азота или серы, то симметрия в них нарушается и они становятся полярными. В качестве примера несимметрично построенной (полярной) молекулы можно привести производное метана — метиловый (древесный) спирт.
Пентан — вещество не полярное, а его производное — амиловый спирт — уже обладает полярностью.
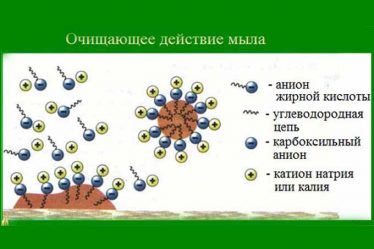
В молекуле жирового мыла имеется сильно полярная карбоксильная группа (COONa) и длинная неполярная углеводородная цепь.
Поверхностная активность полярной молекулы в водном растворе с удлинением углеводородной части (цепи) при той же полярной группе повышается. К поверхностно-активным полярным веществам относится много органических соединений: спирты, кислоты, амины, фенолы и т. п.
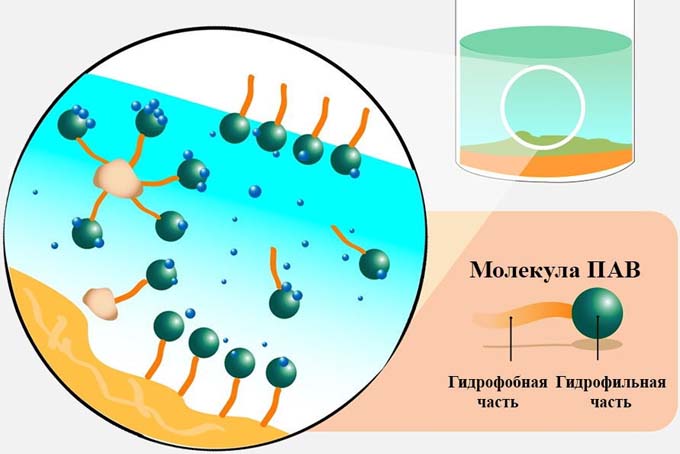
Молекула жирового мыла сочетает в себе два ярко выраженных взаимнопротивоположных свойства: один ее конец (полярный) гидрофилен, другой (неполярный) — гидрофобен. Полярный конец обусловливает ее растворимость в воде, неполярный (углеводородный) затрудняет, тормозит это растворение и стремится вытеснить молекулу мыла из внутренних слоев воды на ее поверхность, т. е. на границу ее раздела с воздухом, ибо воздух, являясь гидрофобным веществом, имеет сродство к гидрофобной части молекулы мыла.
Обладая такими свойствами, молекулы мыла, растворяясь в воде, будут стремиться вытеснить молекулы воды из пограничного слоя и занять их место.
Поверхностно-активные вещества
Таким образом, на поверхности водного раствора происходит так называемый процесс адсорбции — скопление полярных молекул мыла, где они, концентрируясь, образуют сплошное покрытие —- адсорбционный слой, который как бы обволакивает поверхность воды. По существу на этой поверхности образуется слой нового вещества, имеющий меньшее поверхностное натяжение, чем вода. Следовательно, и поверхностное натяжение этого водного раствора соответственно понижается. Так, например, если ввести в воду этиловый спирт (поверхностно-активное-вещество), поверхностное натяжение которого равно 22 эрг/см2 (напомним, что для воды оно равно 73 эрг/см2), то часть молекул спирта в силу своей поверхностной активности, оттеснившись на поверхность воды, образует новый поверхностный слой, состоящий главным образом из молекул спирта. В связи с этим поверхностное натяжение спиртового раствора значительно снизится. Тем же объясняется и приведенный ранее пример падения поверхностного натяжения воды после прибавления в нее незначительного количества олеинового мыла, являющегося полярным веществом.
При этом необходимо подчеркнуть, что в образовавшейся на поверхности мыльного раствора мыльной пленке молекулы мыла располагаются в определенном порядке — перпендикулярно к поверхности раздела жидкости: гидрофобным, углеводородным концом они обращены в воздух, гидрофильным же, полярным концом направлены в воду, молекулы которой тоже полярны.
Таким образом, на всей поверхности воды образуется своеобразный сплошной «частокол» из молекул мыла, углеводородные концы которых торчат из воды, а полярные их концы погружены в ее поверхностный слой. Этот молекулярный «частокол» для образности можно сравнить с волосками меха, каждый из которых как бы представляет собой гидрофобный конец молекулы мыла, торчащий из воды.
Развитие химической промышленности коренным образом меняет бытовую сферу каждого человека. Раньше люди пользовались в основном естественными, природными материалами — шкуры, меха, войлок. А теперь из современных синтетических волокон производят матрасы высочайшего качества и удобства, прочные и долговечные. Такие изделия гораздо практичнее и лучше своих исторических предшественников. На технологичных кроватях и выспаться получается быстрее, и отдых лучше.